Adsorpsi Antigen ke Adjuvant Aluminium
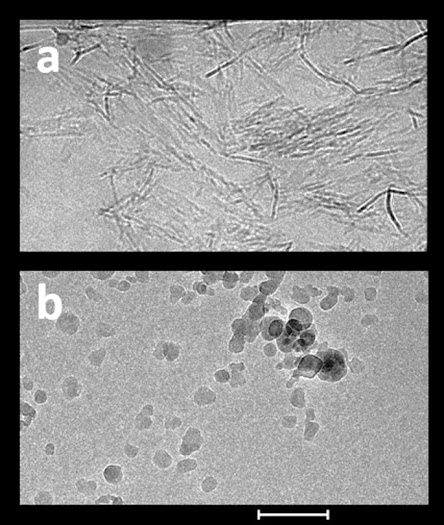
Ajuvan aluminium terdiri dari partikel primer skala nano (Gambar). Nanopartikel AH berbentuk memanjang, berukuran sekitar 4 × 2 × 10 nm, sedangkan nanopartikel AP berbentuk seperti pelat dengan diameter sekitar 50 nm. Nanopartikel ini membentuk agregat berpori yang terhubung secara longgar yang bervariasi dalam ukuran dari 1 hingga sekitar 20 µm tergantung pada bahan adjuvant, metode yang digunakan untuk pengukuran ukuran partikel, dan kondisi percobaan. Paparan gaya geser dan ultrasonikasi menurunkan ukuran partikel bahan adjuvant agregat, sedangkan suspensi bahan adjuvant dalam garam meningkatkan agregasi dan ukuran agregat. Kemampuan agregat untuk berdisosiasi dan berkumpul kembali pada pencampuran berkontribusi pada pemerataan antigen yang teradsorpsi dalam formulasi vaksin. Nanopartikel primer yang membentuk agregat memberikan kontribusi yang sangat besar permukaan, diperkirakan 514 m2/g untuk AH (Rehydragel HPA), bila diukur dengan adsorpsi air menggunakan spektroskopi inframerah gravimetri. Luas permukaan yang jauh lebih kecil dilaporkan untuk Alhydrogel (350 m2/g) dan Rehydragel LV (300 m2/g), tetapi ini ditentukan oleh adsorpsi nitrogen yang secara signifikan meremehkan luas permukaan sebagai akibat dari dehidrasi sampel dan runtuhnya agregat. Selama penyimpanan di suhu kamar, bahan adjuvant aluminium menjadi lebih teratur karena deprotonasi dan dehidrasi. Proses "penuaan" ini mengurangi luas permukaan dan menghasilkan sedikit pengurangan kapasitas penyerapan selama periode 15 bulan.
Adsorpsi antigen ke bahan adjuvant aluminium dapat
berkontribusi langsung pada efek peningkatan kekebalan dari bahan adjuvant
aluminium seperti yang dibahas di bawah ini. Selain itu, adsorpsi ke adjuvant
dapat mencegah adsorpsi antigen ke dinding vial atau spuit, sehingga memastikan
injeksi antigen dosis penuh. Adsorpsi antigen ke adjuvant terjadi melalui
mekanisme hidrofobik, elektrostatik, dan pertukaran ligan, antara lain. Antigen
yang dimurnikan atau disintesis secara kimia adalah struktur kompleks besar
yang terdiri dari protein yang terdiri dari beragam 20 asam amino,
kadang-kadang terkonjugasi dengan rantai oligo- atau polisakarida dan lipid.
Keragaman ini membuat sulit untuk memprediksi perilaku adsorpsi antigen pada
bahan adjuvant aluminium, seperti juga kasus interaksi protein dengan permukaan
padat lainnya. Protein cenderung teradsorpsi ke permukaan padat dan umumnya
adsorpsi tertinggi ketika pH mendekati iep protein. Meskipun sebagian besar
residu hidrofobik terkubur di dalam protein globular, protein memiliki residu
hidrofobik di permukaan yang dapat berinteraksi dengan antarmuka padat. Ukuran
dan distribusi tambalan hidrofobik ini menentukan kekuatan interaksi
hidrofobik. Selain itu, adsorpsi antigen protein dapat mengakibatkan pembukaan
sebagian, menghasilkan paparan residu hidrofobik tambahan, yang selanjutnya
berinteraksi dengan permukaan adjuvant. Ini dapat berkontribusi pada
peningkatan kekuatan adsorpsi pada penuaan campuran antigen-adjuvant tertentu
Interaksi elektrostatik terjadi ketika antigen dan adjuvant
memiliki muatan yang berlawanan dan merupakan mekanisme utama untuk adsorpsi
antigen ke adjuvant aluminium. Pada pH netral, AH memiliki muatan permukaan
positif dan AP memiliki muatan permukaan negatif. IEP antigen protein dapat
digunakan sebagai titik awal untuk menentukan apakah kemungkinan akan mengalami
adsorpsi elektrostatik ke AH atau AP. Namun, penting untuk mengenali bahwa IEP
mewakili jaringan semua gugus bermuatan protein dan bahwa distribusi muatan
akan mempengaruhi interaksi dengan partikel ajuvan. Kasus ekstrim dari
literatur terdiri dari protein fusi yang terdiri dari dua peptida, satu dengan
iep 10 dan peptida kedua dengan iep 5,5. Meskipun iep rata-rata adalah 9,3, ia
teradsorpsi dengan baik untuk AP dan AH mungkin dengan orientasi yang
berbeda.
Interaksi terkuat antara adjuvant aluminium dan antigen
didorong oleh mekanisme pertukaran ligan. Seperti disebutkan di atas, aluminium
memiliki afinitas tinggi untuk fosfat, dan fosfat dapat bertukar gugus
hidroksil pada permukaan bahan adjuvant aluminium. Kehadiran dan paparan gugus
fosfat terminal dalam beberapa antigen memungkinkan pengikatan melalui
pertukaran ligan. Pengikatan antigen tersebut ke bahan adjuvant aluminium
melalui pertukaran ligan bahkan dapat mengatasi tolakan elektrostatik.
Pertukaran ligan terjadi dengan kedua jenis ajuvan aluminium, tetapi lebih kuat
di AH karena ajuvan ini memiliki lebih banyak hidroksil permukaan yang tersedia
daripada AP. Pertukaran ligan mungkin terlibat dalam pengikatan partikel mirip
virus hepatitis B surface antigen (HBsAg), kemungkinan melalui pembentukan
gugus fosfat terminal dengan hidrolisis fosfolipid terbatas. Terminal fosfat
(PO4) atau fosfonat (CH2-PO3) gugus juga dapat ditambahkan ke antigen protein
melalui konjugasi dengan fosfoserin atau dengan penghubung yang dirancang
khusus dengan satu atau lebih gugus fosfonat terminal. Konjugasi lisozim dengan
dua penghubung fosfonat memungkinkan pengikatan lisozim ke AH terlepas dari
kenyataan bahwa kedua senyawa tersebut membawa muatan positif. Ketersediaan
gugus hidroksil permukaan untuk pertukaran ligan dapat ditentukan dengan
mengukur fosfofilisitas permukaan. Uji ini menggunakan senyawa kromogenik atau
fluorogenik dengan gugus fosfat terminal. Adsorpsi melalui pertukaran ligan
menghasilkan hidrolisis dan pelepasan produk berwarna atau fluoresen.
Tingkat adsorpsi antigen biasanya dihitung dengan menentukan
jumlah protein dalam supernatan setelah sentrifugasi campuran antigen-bahan adjuvant,
setelah inkubasi jangka pendek. Jumlah protein dalam supernatan hanya dikurangi
dari jumlah yang awalnya ditambahkan, untuk menentukan jumlah teradsorpsi.
Dengan menambahkan jumlah antigen yang berbeda sambil menjaga konsentrasi bahan
adjuvant konstan, kapasitas adsorpsi bahan adjuvant untuk antigen tertentu
dapat ditentukan dengan membangun isoterm adsorpsi. Proses ini agak melelahkan,
tetapi dapat dengan mudah diotomatisasi menggunakan sistem penanganan cairan
dengan throughput tinggi. Adsorpsi antigen protein ke bahan adjuvant aluminium
biasanya dianalisis menurut model adsorpsi Langmuir, yang memungkinkan
penghitungan beberapa parameter adsorpsi termasuk koefisien adsorpsi, korelasi
kekuatan interaksi antigen-ajuvan. Namun, meskipun isoterm adsorpsi dapat
menyerupai model Langmuir, adsorpsi protein ke permukaan padat tidak memenuhi
premis di mana model Langmuir digunakan. based. Pendekatan alternatif untuk
menentukan kekuatan adsorpsi adalah untuk menilai tingkat desorpsi pada paparan
serum atau cairan getah bening, atau untuk melakukan studi dalam buffer
kekuatan ionik yang lebih tinggi untuk bersaing dengan antigen. Namun, evaluasi
dengan adanya serum atau getah bening memerlukan tes antigen spesifik untuk
menentukan konsentrasi antigen dalam cairan kompleks ini. Desorpsi dapat
dihasilkan dari paparan anion yang mengalami pertukaran ligan dengan hidroksil
permukaan pada permukaan adjuvant, atau perpindahan kompetitif oleh protein
lain seperti fibrinogen. Sebuah uji desorpsi kuantitatif dikembangkan untuk
HBsAg berdasarkan afinitas tinggi aluminium untuk fluor. Anion fluorida
memiliki afinitas yang lebih tinggi terhadap aluminium daripada fosfat dan
dapat mendesorbsi antigen terfosforilasi seperti HBsAg. Derajat desorpsi
berbanding terbalik dengan kekuatan adsorpsi. Metode alternatif adalah untuk
menentukan pengaruh adsorpsi antigen pada adsorpsi dan hidrolisis senyawa
fluorogenik. Penurunan hidrolisis (disebut fosfofilisitas permukaan relatif)
berkorelasi terbalik dengan afinitas antigen. Kekuatan adsorpsi merupakan
parameter penting karena adsorpsi yang terlalu ketat dapat mengganggu respons
antibodi, seperti yang diilustrasikan oleh model antigen alfa-kasein, yang
memiliki delapan gugus fosfat yang tersedia untuk pertukaran ligan,
menghasilkan adsorpsi yang kuat pada AH. Kasein yang teradsorpsi kuat tidak
menginduksi aktivasi sel-T mungkin karena adsorpsi mengganggu pemrosesan
antigen. Pengurangan kekuatan adsorptif dengan pretreatment AH dengan buffer
fosfat memungkinkan aktivasi sel T dan menghasilkan respon antibodi yang lebih
kuat. Demikian pula, respon antibodi terhadap HBsAg ditingkatkan dengan
pretreatment AH dengan buffer fosfat dibandingkan dengan AH saja. kekuatan juga
dapat mempengaruhi tingkat perubahan struktural berikut adsorpsi dan,
karenanya, integritas epitop konformasi. Pengaruh kekuatan adsorpsi pada luas
dan besarnya respon imun adalah area yang memerlukan penyelidikan lebih lanjut,
terutama dengan antigen baru.
Jumlah protein yang diadsorpsi ke bahan adjuvant aluminium
juga dapat ditentukan secara langsung. Uji o-phthalaldehyde (OPA) mengukur
sinyal fluoresen yang dibuat ketika OPA bereaksi dengan gugus amina terminal
dan telah digunakan untuk menentukan jumlah protein yang teradsorpsi pada AH.
Keterbatasan pengujian termasuk sensitivitasnya, karena hanya dapat digunakan
untuk konsentrasi protein lebih besar dari 25 µg/ml, dan tidak cocok untuk
beberapa formulasi, karena gangguan dari eksipien yang mengandung gugus amina
(seperti buffer Tris). Sebuah metode alternatif adalah untuk mengukur kandungan
nitrogen total dengan chemiluminescence, meskipun teknik ini juga tunduk pada
interferensi dari eksipien yang mengandung gugus amina. Selain itu, adsorpsi
spesifik antigen dapat ditentukan dengan panel antibodi monoklonal baik dengan
fluoresensi berbasis pelat atau flow cytometry. Tes ini memerlukan antibodi
spesifik antigen yang dikarakterisasi dengan baik, tetapi memiliki keuntungan
bahwa adsorpsi antigen spesifik dapat ditentukan dalam vaksin kombinasi yang
mengandung banyak antigen. Selain itu, penelitian tersebut dapat memberikan
informasi tentang stabilitas struktural dari antigen yang teradsorpsi.
Seseorang harus berhati-hati untuk menghindari atau mengontrol adsorpsi
langsung antibodi terhadap bahan adjuvant aluminium dalam pengembangan
pengujian tersebut. Kami juga telah menjelaskan pendekatan berbasis Luminex® di
mana tingkat adsorpsi beberapa antigen dapat dievaluasi secara bersamaan dalam
vaksin kombinasi kompleks. Penggunaan antibodi untuk mengevaluasi integritas
antigenik dalam vaksin teradsorpsi juga menawarkan peluang untuk mengembangkan
potensi in vitro tes.
Selain karakterisasi antigen yang teradsorpsi pada garam
aluminium, penting juga untuk memahami efek antigen dan komponen vaksin lainnya
pada sifat fisikokimia garam aluminium itu sendiri. Perubahan tersebut dapat
berdampak pada reproduktifitas eksperimen dan kinerja produk, jika tidak
dipahami dan dikontrol dengan baik. Berbagai teknik karakterisasi berguna untuk
menjelaskan sifat fisikokimia garam aluminium. Karena sifat garam aluminium
yang heterogen, analisis ukuran partikel paling baik dilakukan dengan
menggunakan kombinasi teknik pelengkap daripada mengandalkan teknik tunggal.
Misalnya, banyak agregat partikel dalam AH dan AP mungkin berukuran terlalu
besar untuk dinilai secara akurat dengan hamburan cahaya dinamis. Dalam hal
ini, ukuran partikel difraksi laser dan mikroskop optik dan/atau elektron
mungkin berguna. Teknik karakterisasi lain yang relevan termasuk difraksi
sinar-X untuk menilai struktur kristal formulasi aluminium, mikroelektroforesis
untuk memantau perubahan potensial zeta, dan profil laser scattering optical untuk
mengukur laju sedimentasi.
Lebih lanjut, penting untuk dicatat bahwa pemrosesan garam
aluminium (misalnya untuk pengisian/penyelesaian produk vaksin) juga dapat
menimbulkan tantangan. Misalnya, karena laju sedimentasi yang relatif cepat,
perhatian harus diberikan untuk memastikan bahwa proses pengisian/penyelesaian
dapat secara akurat mengontrol jumlah bahan adjuvant aluminium di setiap botol.
Kandungan ion aluminium dapat dinilai dengan analisis unsur (misalnya
spektroskopi emisi atom plasma yang digabungkan secara induktif).







No comments