Interaksi Nano atau Mikro dengan Sistem Imun
Bergantung pada rute pemberiannya, partikel nano dan mikro pertama kali bertemu dengan sel imun bawaan seperti makrofag atau dendritic cells (DC) (Gambar). Antigen-presenting cells (APCs), seperti makrofag, sel B, atau DC—APC yang paling kuat, membantu perkembangan dari respons imun bawaan menjadi adaptif. Penyerapan partikel multimerik oleh APC menghasilkan aktivasinya melalui pattern recognition receptors (PRRs)-seperti Toll-like receptors (TLRs) atau C-type lectin receptors (CLRs)—yang mengarah pada respons pro-inflamasi dan selanjutnya internalisasi partikel, antigen pengolahan dan presentasi. Oleh karena itu, mikropartikel atau nanopartikel seperti VLP dapat meningkatkan aktivasi DC dan penyajian antigen oleh molekul MHC kelas I atau II, yang pada akhirnya mengarah pada respons awal CD8+ dan CD4+. Plastisitas platform pengiriman nano dan mikro memungkinkan penargetan pasif APC untuk mengoptimalkan efisiensi internalisasi dan, pada akhirnya, memaksimalkan respons imun yang ditimbulkan. Menurut kekakuan partikel, bentuk, muatan permukaan dan ukuran, biodistribusi diferensial dan serapan partikel telah diamati. Imunogenisitas sangat dipengaruhi oleh sifat pengeringan partikel antigenik. Nanopartikel dengan diameter kurang dari 200 nm terdistribusi lebih cepat ke kelenjar getah bening sedangkan nanopartikel lebih dari 500 nm dan mikropartikel diambil di tempat injeksi oleh jaringan DC dan makrofag, dan secara aktif diangkut ke jaringan limfatik. Dengan demikian, melalui cairan interstisial dan pembuluh limfoid pengumpul, partikel yang lebih kecil (<50 nm) dapat mencapai organ limfoid (seperti limpa atau kelenjar getah bening) lebih efisien dan berinteraksi dengan DC folikular dan sel T dan B residen. Selain itu, DC lebih suka menginternalisasi partikel ukuran kecil (ukuran virus). Demikian pula, serapan makrofag tampaknya juga dibatasi oleh ukuran partikel dan muatan permukaan. Bagaimanapun, penargetan aktif dapat secara signifikan mengoptimalkan DC dan efisiensi internalisasi makrofag.
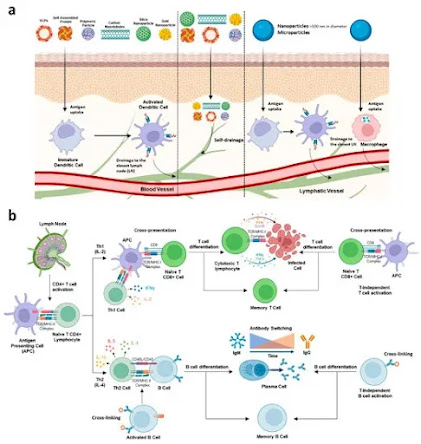
Gambar Sistem pengiriman nano dan mikropartikel menginduksi respon imun humoral dan seluler. (a) Penyerapan partikel oleh antigen-presenting cells (APCs) adalah langkah penting untuk induksi respons imun yang kuat. Tergantung pada berbagai faktor, nanopartikel dapat diinternalisasi oleh APC atau langsung mencapai jaringan limfatik melalui pembuluh limfatik. Mikropartikel difagositosis oleh APC. (b) Setelah presentasi antigen oleh APC, sel T CD4+ berdiferensiasi menjadi Th1, mempromosikan generasi sel T sitotoksik dan memori dengan presentasi silang, atau Th2, meningkatkan diferensiasi sel B menjadi sel B plasma atau memori. Nano- dan mikropartikel juga dapat mempromosikan aktivasi sel T dan B independen dari sel Th.
Induksi kedua lengan sistem imun adaptif, respons yang
dimediasi sel dan yang dimediasi antibodi, adalah kunci untuk pembersihan
patogen virus dan telah dicapai dengan menggunakan sistem nano atau
mikrocarrier (Gambar). Setelah penyerapan partikel, protein antigenik yang
dikirim sebagai VLP atau oleh sistem pembawa lainnya diproses dan peptida
antigenik disajikan dengan efisiensi yang sama pada molekul MHC-I atau MHC-II
oleh APC untuk memicu aktivasi sel T CD8+ atau sel Th CD4+. Teknologi ini
menginduksi stimulasi kuat dari respon Th1 dan Th2. Dalam beberapa kasus,
mikropartikel dan nanopartikel dengan ukuran> 500 nm menunjukkan
kecenderungan untuk menginduksi respon Th2 sedangkan partikel <100 nm
tampaknya menginduksi respon Th1-bias. Antigen eksogen, seperti yang ada dalam
VLP atau sistem partikulat lainnya, biasanya disajikan oleh molekul MHC-II
tetapi juga dapat berikatan dengan molekul MHC-I. Presentasi silang—atau
cross-priming—yang merupakan presentasi peptida antigenik dari protein eksogen
pada molekul MHC kelas I oleh APC, merupakan langkah penting untuk inisiasi
respons sel T CD8+. Respon Cytotoxic T-lymphocyte (CTL) sangat penting untuk
pembersihan patogen virus, seperti BTV, AHSV dan EHDV. Perluasan sel T CD8+
telah diamati pada pejamu yang terinfeksi BTV dan AHSV dan divaksinasi. Memang,
hewan yang terinfeksi dapat memasang respons protektif yang diperantarai sel T
CD8+ terhadap serotipe BTV dan AHSV yang homolog dan tidak terkait dengan
heterolog—dengan protein yang sangat terkonservasi VP7, NS1 dan NS2 sebagai
target potensial—tanpa adanya neutralizing antibodies (Nabs). Dalam hal ini,
cross-priming DC sel T sitotoksik memainkan peran penting setelah vaksinasi VLP.
Dibandingkan dengan antigen terlarut, pengiriman antigen oleh nano atau
mikropartikel mempromosikan scape endosom melalui berbagai mekanisme setelah
penyerapan struktur ini oleh DC profesional, sehingga meningkatkan akses
antigen eksogen ke jalur klasik MHC kelas I dan sel-T cross-priming dan
aktivasi berikutnya. Namun, ukuran partikel mempengaruhi jalur presentasi
silang untuk antigen tertentu. Dalam hal ini, hasil pembentukan kompleks
peptida kelas I MHC dapat berbeda antara 'fagosom-ke-sitosol' dan jalur pemuatan
endosomal langsung, yang dapat menjelaskan kemanjuran nanopartikel yang lebih
tinggi untuk menginduksi presentasi silang MHC kelas I.
Meskipun orbivirus dapat merusak respon sel B secara
sementara, imunitas humoral juga dipicu setelah infeksi dengan BTV, AHSV atau
EHDV, dengan protein virion yang paling terpapar dan penentu utama serotipe
virus, VP2, sebagai target utama Nabs. Perkembangan sel Th2 selanjutnya
mengarah pada ekspansi klonal sel B dan pematangan afinitas antibodi yang
diproduksi. Peralihan kelas imunoglobulin menuju IgG didorong oleh interaksi
sel Th2 dengan sel B yang diaktifkan. Sistem partikulat, seperti VLP, adalah
stimulator kuat dari respons imun yang diperantarai sel-B. Struktur antigenik
yang sangat terorganisir dan padat ini mendorong cross-linking langsung dengan
BCR dan aktivasi sel B, yang mengarah pada internalisasi partikel, proliferasi
sel B dan peningkatan ekspresi MHC-II dan molekul kostimulator. Selain itu,
karena pengulangan struktural dari sistem nano dan mikrocarrier ini, stimulasi
respon imun humoral sel-T berdasarkan IgM dan IgG telah diamati. Tidak hanya
itu, VLP dan mikro atau nanocarrier lainnya juga memiliki potensi untuk
menginduksi respon CTL secara independen dari sel CD4+ Th dan mampu menginduksi
sel plasma yang mensekresi antibodi dan sel memori B dan T memori yang berumur Panjang.





No comments