Virus Bluetongue
Bluetongue virus (BTV) adalah jenis spesies dari genus Orbivirus dan agen penyebab bluetongue (BT), penyakit ruminansia hemoragik dengan kisaran inang yang luas, meskipun mortalitas dan morbiditas bervariasi antar spesies. Penyakit ini terutama menyerang domba dan beberapa ruminansia liar seperti rusa berekor putih (Odocoileus virginianus), dengan tingkat kematian yang signifikan. Sebaliknya, kambing, sapi, dan sebagian besar ruminansia liar biasanya menunjukkan tanda-tanda BT subklinis atau asimtomatik. Secara tradisional, distribusi global BTV tertutup untuk wilayah antara sekitar 50 ° LU dan 35 ° S. Meskipun demikian, ekspansi ke utara telah terjadi selama beberapa tahun terakhir, dengan itu diidentifikasi di semua benua kecuali Antartika. Dampak ekonomi BT di seluruh dunia diperkirakan mencapai 3 miliar dolar AS per tahun. Pengeluaran tersebut merupakan akibat dari hilangnya produktivitas, kematian hewan, pembatasan perdagangan hewan dan pelaksanaan tindakan pengawasan. Dengan demikian, penyakit ini termasuk dalam daftar penyakit yang dapat diberitahukan dari World Organization for Animal Health (WOAH, mantan OIE) karena konsekuensinya yang merugikan dalam industri peternakan. Lebih dari 29 serotipe telah diidentifikasi sejauh ini, berdasarkan studi filogenetik yang ekstensif, data sekuensing dan uji netralisasi silang. Distribusi global serotipe BTV individu sangat heterogen. Pendekatan konvensional berdasarkan vaksin yang dilemahkan atau hidup yang dilemahkan telah diizinkan mengandung BTV. Namun, mereka menghadirkan beberapa perangkap, menyoroti spesifisitas serotipe mereka dan kurangnya sifat DIVA. Upaya besar telah dilakukan untuk mengembangkan vaksin generasi berikutnya yang dapat mengatasi kekurangan vaksin klasik yang dipasarkan ini, termasuk vaksin subunit, vektor virus, DISC (disabled infectious single cycle) dan DISA (disabled infectious single animal).
Virus-Like Particles (VLPs)
VLP dan CLP (core-like particles) telah dievaluasi secara
ekstensif sebagai vaksin berbasis nanopartikel potensial untuk melawan BTV. CLP
dan VLP BTV homogen pertama kali assembled dalam sistem ekspresi sel serangga
baculovirus. CLP terdiri dari ekspresi simultan dari VP3 dan VP7 tanpa adanya
kompleks polimerase (VP1, VP4 dan VP6) dan protein non-struktural, yang identik
dalam ukuran dan bentuk dengan inti BTV asli. VLP terdiri dari partikel inti
(VP3 dan VP7) dan lapisan kapsid luar (VP2 dan VP5), dan menyerupai BTV dalam
ukuran, penampilan dan konstitusi biokimia, tidak memiliki RNA untai ganda dan
kompleks RNA polimerase. VP3 dan VP7 relatif terkonservasi dengan baik antara
serotipe sehingga protein kapsid luar dari serotipe yang berbeda dapat dilapisi
ke protein inti dalam heterolog, yang menyiratkan keuntungan dari sistem VLP
ini untuk menghasilkan vaksin untuk serotipe baru dengan mengganti VP2, BTV
yang paling bervariasi protein. Terlepas dari sistem ekspresi baculovirus,
sistem ekspresi tingkat tinggi berbasis tanaman juga diimplementasikan untuk
menghasilkan partikel BTV yang mirip subcore, core, dan virus.
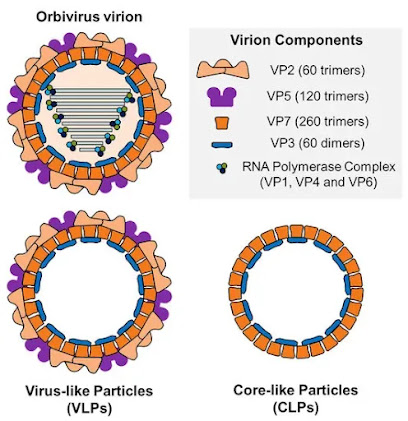
Gambar Representasi diagram dari bagian virion orbivirus, virus-like particle (VLP) dan core-like particle (CLP). 60 trimer VP2 dan 120 trimer VP5 merupakan kapsid luar virion. Inti terdiri dari lapisan protein perantara, terdiri dari 260 trimer VP7, dan kapsid bagian dalam yang dibentuk oleh 60 dimer VP3. Di dalam inti, VP1, VP4 dan VP6 membentuk kompleks RNA polimerase. VLP kekurangan materi genetik serta komponen kompleks RNA polimerase. CLP adalah kumpulan protein yang baru saja dibentuk oleh VP7 dan VP3.
Mengenai evaluasi mereka sebagai kandidat vaksin, CLP
menunjukkan imunogenisitas in vivo tetapi tidak sepenuhnya protektif terhadap
BTV. Protein inti luar utama dan antigen reaktif silang VP7 telah terbukti
protektif terhadap BTV. Jadi, meskipun CLPs kekurangan penentu imunogenisitas
utama VP2, induktor utama neutralizing antibodies (NAbs), induksi respons imun
yang dimediasi sel spesifik dari VP7 dapat menjelaskan kapasitas perlindungan
ringan yang diamati. Sebaliknya, VLP mampu memberikan perlindungan spesifik
serotipe dari penyakit klinis dan replikasi virus pada domba, salah satu inang
BTV alami, bahkan dalam jangka panjang. Meskipun demikian, perlindungan lengkap
terhadap BTV tergantung pada pemanfaatan adjuvant, karena VLP bebas adjuvant
terbukti hanya sebagian protektif pada domba, menginduksi tingkat NAbs yang
rendah. Sebagaimana dinyatakan di atas, salah satu kelemahan utama dari
vaksinasi BTV adalah spesifisitas serotipe. Perlindungan silang hanya sebagian
dicapai terhadap serotipe terkait filogenetik setelah imunisasi dengan VLP.
Akibatnya, alasannya adalah desain campuran VLP dari berbagai serotipe yang
dapat bekerja sebagai vaksin multivalen. Strategi ini telah berhasil
dieksplorasi sebagai kandidat vaksin multivalen yang dilindungi terhadap
serotipe homolog. Mempertimbangkan bahwa pengembangan vaksin multivalen dapat
menginduksi gangguan kekebalan antara antigen berbeda yang ada dalam formulasi
vaksin yang sama, penting untuk dicatat bahwa kombinasi VLP yang mengandung VP2
dari serotipe yang berbeda tidak menyebabkan gangguan apa pun, yang menempatkan
koktail VLP sebagai DIVA potensial, multiserotipe dan vaksin yang aman secara
inheren terhadap BTV. Namun demikian, kandidat vaksin ini belum dipasarkan,
meskipun terbukti efektif, aman dan kandidat DIVA, sesuatu yang dapat
dijelaskan dengan keterjangkauan yang rendah. Dengan cara yang sama, VLP yang
diproduksi tanaman menawarkan kekebalan protektif terhadap serotipe homolog sehingga
produksi VLP pada tanaman dapat bekerja sebagai alternatif yang lebih hemat
biaya dengan keuntungan skalabilitas yang layak. Setidaknya, alternatif yang
masuk akal dan lebih mungkin terjangkau untuk BTV VLP adalah kompleks enzim Self-Assembled
60-mer yang terbuat dari lumazine synthase dari hipertermofil Aquifex aeolicus
yang membawa imunodominan VP2. Nanopartikel mirip virus ini telah diterapkan
untuk identifikasi reseptor inang selama masuknya virus, tetapi potensinya
sebagai kandidat vaksin terhadap BTV belum dikarakterisasi sejauh ini.
Salah satu eksploitasi VLP adalah penggunaannya sebagai
pembawa epitop asing. Virus penyakit hemoragik kelinci VP60 VLPs yang membawa
epitop enam residu dari protein kapsid virus BTV VP7 adalah contohnya. Kandidat
vaksin ini tidak dievaluasi lebih lanjut sebagai kandidat vaksin [183]. CLP BTV
juga telah dieksplorasi sebagai platform pengiriman. Ini dimuat di permukaannya
dengan antigen heterolog seperti preS2 dari virus hepatitis B, epitop
imunogenik dari glikoprotein virus rabies, epitop sel T dari protein matriks
(M1) virus influenza A atau urutan bovine leukemia virus (BLV) protein gp51.
EIII ektodomain dari dengue virus serotypes 1 (DENV1) dan 4 (DENV4), dan virus
Zika, juga telah ditampilkan pada permukaan bagian dalam CLP BTV yang menyatu
dengan ujung terminal amino VP3. Meskipun strategi ini menunjukkan beberapa
imunogenisitas ringan terhadap antigen asing, panjang urutan yang dimasukkan
asam amino secara dramatis mengkondisikan perakitan dan stabilitas CLP chimeric
dalam beberapa kasus.
Avian Reovirus µNS- Mikrosfer yang Membawa Antigen BTV
Baru-baru ini, penelitian yang berbeda telah mencatat kemampuan
protein non-struktural NS1 BTV yang dilestarikan untuk mempromosikan respons
sel T CD8+ spesifik yang mampu melindungi hewan yang diimunisasi terhadap
beberapa serotipe BTV yang tidak terkait. Kombinasi antibodi penetral virus dan
cytotoxic T lymphocytes (CTLs) sangat penting untuk pengembangan kekebalan
jangka panjang pada hewan yang terinfeksi BTV. Respon imun yang diinduksi oleh
BTV VLPs sangat didasarkan pada induksi NAbs, meskipun kehadiran VP7 juga dapat
merangsang respon yang dimediasi sel cross-reactive. Imunisasi dengan NS1, VP2
dan VP7 dimuat pada avian reovirus muNS-mikrosfer mendorong kedua lengan respon
imun adaptif, memberikan kekebalan steril terhadap serotipe BTV homolog pada
tikus IFNAR(-/-), terutama dimediasi oleh pemicu antibodi penetralisir dan
aktivasi sel T CD4+. Kombinasi heterolog dengan vektor modified vaccina Ankara (MVA)
yang dimodifikasi yang mengekspresikan antigen BTV ini menyebabkan perlindungan
heterolog lengkap terhadap BTV, yang dapat mengandalkan respons sel spesifik
BTV yang lebih kuat yang dipengaruhi oleh vektor virus yang digunakan. Selain
itu, BTV-muNS-MS menghadirkan kapasitas ajuvan intrinsik, yang berbeda dari
respons yang bergantung pada ajuvan VLP. Meskipun demikian, hasil pada
kemanjuran BTV-muNS-MS pada model tikus harus diuji dalam inang alami BTV. Karena
plastisitas dan metode produksi yang mudah yang tersirat dalam teknologi ini,
antigen BTV tambahan dapat dimasukkan dalam formulasi vaksin subunit ini, seperti
halnya NS2 atau ujung terminal aminonya (NS2-Nt), di mana kombinasi dengan NS1
mengoptimalkan perlindungan multiserotipe yang ditimbulkan oleh NS1 saja,
menghindari perkembangan penyakit klinis pada domba.
Platform Vaksin Nanopartikel Self-Assembled Berdasarkan
Tubulus BTV-NS1
Ciri infeksi BTV adalah pembentukan struktur tubular dengan
diameter ~52,3 nm dan panjang ~100 nm di dalam sitoplasma sel yang terinfeksi,
yang berasal dari multimerisasi protein non-struktural 1 (NS1). Protein 64 kDa
NS1, yang bertindak sebagai regulator positif sintesis protein virus, adalah
protein virus paling melimpah yang diekspresikan dalam sitoplasma sel yang
terinfeksi BTV dan merupakan satu-satunya yang bertanggung jawab untuk
pembentukan karakteristik tubulus heliks dinamis ini. Serupa dengan lapisan fag
berfilamen atau virus mosaik tembakau yang menampilkan antigen asing pada
permukaannya, struktur multimerik NS1 ini telah diusulkan sebagai sistem pengiriman
partikulat yang efisien selama mudah dimurnikan, sangat stabil pada suhu tinggi
(antara 30 dan 45 °C) dan pada pH 7 hingga 8,5, dapat menampung polipeptida
yang lebih besar daripada VLP (hingga 552 asam amino) dan terdiri dari ribuan
monomer NS1, yang akan memastikan paparan antigen asing yang tinggi. C-terminus
protein NS1 secara teratur dibuang pada permukaan tubulus. Penambahan sekuens
epitop asing (sebagai protein fusi atau dengan ikatan silang) di ujung
terminal-C NS1 tidak mengganggu pembentukan tubulus dan memungkinkan paparan
sekuens antigenik di permukaan tubulus NS1. Menariknya, struktur chimeric ini
menunjukkan imunogenisitas terhadap sekuens antigenik yang dimasukkan, berhasil
merangsang lengan seluler dan humoral dari sistem kekebalan in vivo dan
menunjukkan tingkat perlindungan yang signifikan terhadap patogen yang diminati
dalam beberapa kasus.
Mempertimbangkan studi terbaru yang menguatkan kapasitas NS1
untuk secara efisien melindungi terhadap BTV, harus dicatat bahwa pembawa mirip
VLP berbasis NS1 belum dievaluasi sebagai kandidat vaksin terhadap BTV.
Mengingat keuntungan dari teknologi ini, itu adalah pertanyaan yang perlu
dijawab. Jika demikian, dengan mempertimbangkan kemampuan tubulus NS1 ini untuk
secara simultan membawa campuran sekuens antigenik asing yang berbeda, akan
layak untuk menggambarkan vaksin multivalen terhadap penyakit virus ruminansia
yang berbeda. Ini adalah masalah penting ketika mempertimbangkan pengurangan
waktu dan biaya produksi, dan kampanye vaksinasi yang lebih cepat dan efektif.
Serupa dengan beberapa vaksin vektor virus multivalen yang dievaluasi,
pengiriman antigen dari Rift Valley fever virus (RVFV), lumpy skin disease
virus (LSDV), peste des petits ruminants virus (PPRV) atau virus rinderpest
dapat menyebabkan kandidat vaksin multivalen terhadap beberapa patogen
ruminansia ini termasuk BTV.





No comments