Teknik Diagnostik Virus – Teknik Molekuler dan Imunologis
Penyebab paling umum penyakit manusia adalah infeksi virus. Jutaan orang masih meninggal karena infeksi virus, termasuk hepatitis dan human immunodeficiency virus (HIV).
Munculnya virus juga menyebabkan masalah parah bagi populasi
manusia. Beberapa wabah virus emerging telah terjadi di berbagai negara, antara
lain avian influenza A (H5N1), severe acute respiratory syndrome-coronavirus
SARS-CoV (SARS-CoV), pandemic swine flu A (H1N1) virus 2009, Ebola virus (ZIKV
2015), and pandemic SARS-CoV-2 in 2019.
Wabah penyakit coronavirus 2019 baru-baru ini yang
disebabkan oleh SARS/CoV-2 adalah contoh yang sangat baik tentang bagaimana
infeksi virus dapat menimbulkan ancaman serius bagi ekonomi global dan
kesehatan masyarakat. Langkah pertama untuk memerangi infeksi virus adalah
menerima diagnosis yang cepat dan akurat. Sangat penting untuk mendeteksi virus
dalam sampel pasien secara dini dan akurat untuk pengobatan yang tepat,
pengendalian dan pencegahan epidemi.
Teknik Diagnostik Virus
- Diagnosis laboratorium tradisional virus medis dilakukan dengan mengisolasi virus dalam telur ayam berembrio, kultur jaringan atau model hewan. Kemudian, mikroskop elektron digunakan untuk memeriksa secara visual setiap partikel virus dalam sampel.
- Alat diagnostik konvensional seringkali sulit digunakan, mahal, lambat, tidak efisien, dan tidak dapat direproduksi. Diagnostik molekuler telah merevolusi virologi, mendeteksi keberadaan asam nukleat virus dalam sampel pasien.
- Terlepas dari kenyataan bahwa banyak metode tradisional telah digantikan oleh yang berbasis asam nukleat, teknik berbasis imun terus memainkan peran penting dalam deteksi dan pengawasan infeksi virus.
- Deteksi infeksi virus menggunakan metode imunologi melibatkan identifikasi antibodi antivirus dan antigen virus dalam sampel klinis. Kami akan membahas beberapa metode diagnostik molekuler dan imunologis untuk mendiagnosis virus medis.
Teknik Diagnostik Molekuler Virus
Virologi diagnostik telah direvolusi dengan teknik
diagnostik molekuler berbasis asam nukleat. Mereka lebih cepat, lebih sensitif
dan lebih spesifik. Metode ini dapat mendeteksi urutan spesifik asam nukleat
dan dapat digunakan untuk mendiagnosis hampir semua virus yang diketahui
mempengaruhi manusia.
A. Teknik Amplifikasi Berbasis Asam Nukleat
Amplifikasi materi genom virus dengan teknik molekuler
sangat sensitif dan tepat. Hal ini memungkinkan untuk diagnosis cepat dan dapat
mendeteksi beberapa virus secara bersamaan.
Untuk mendeteksi virus yang sulit atau tidak mungkin untuk
dibudidayakan, virus yang tumbuh lambat dalam kultur, atau virus dengan variasi
antigenik, teknik penguatan asam nukleat dapat sangat membantu.
Dalam mendiagnosis infeksi virus yang disebabkan oleh beberapa
virus, tes penguatan asam nukleat sangat populer. Mereka termasuk virus
hepatitis C, virus dengue dan Epstein-Barr virus (EBV), virus influenza serta Zika
virus (ZIKV), Ebolavirus, dan coronavirus.
Contoh Teknik Amplifikasi Berbasis Asam Nukleat
Ada berbagai metode amplifikasi asam nukleat yang dapat digunakan untuk mendiagnosis infeksi virus di laboratorium. Ini semua dibahas di bawah ini.
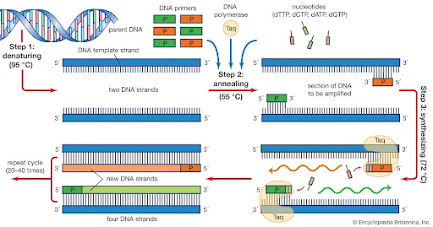
1. Polymerase Chain Reaction (PCR)
- PCR adalah contoh umum dari tes amplifikasi asam nukleat.
- Sejak diciptakan oleh Mullis dan Faloona, ia telah merevolusi diagnostik molekuler.
- PCR melibatkan ekstraksi dan pemurnian molekul DNA dan amplifikasi eksponensial menggunakan DNA polimerase eksponensial.
- Produk yang diperkuat kemudian dapat dideteksi menggunakan berbagai teknik setelah reaksi PCR. Ini termasuk elektroforesis gel dan metode kolorimetri serta sekuensing.
- Sejak awal, PCR digunakan untuk mendeteksi infeksi virus pada manusia. Sensitivitas klinis keseluruhan berkisar dari 77,8% hingga 100% dan spesifisitas klinis berkisar antara 89% hingga 100%.
- Fleksibilitas PCR menjadikannya alat yang serbaguna. Ada banyak variasi PCR, tetapi dua yang paling penting adalah reverse transcription-PCR (RTPCR) dan real-timePCR. Yang pertama digunakan untuk target amplify ribonucleic acids (RNA). Yang kedua digunakan untuk mengukur deoxyribonucleic acids (DNA) secara real-time selama reaksi PCR.
Keuntungan
- Sensitif, spesifik
- Metode deteksi berbasis asam nukleat yang banyak digunakan
- Potensi deteksi multipleks
Keterbatasan
- Risiko kontaminasi tinggi
- Inhibitor tidak dianjurkan
- labor-intensive dan memakan waktu
- Kualitatif
- Dokumentasi gel apparatus dan pengendara thermal cycler diperlukan
2. Reverse Transcription-PCR (RT-PCR)
- RT-PCR dirancang untuk memperkuat target RNA.
- Teknik ini menggunakan reverse transcriptase untuk mengubah target RNA virus menjadi complementary DNA (cDNA). cDNA yang dihasilkan kemudian dapat diamplifikasi menggunakan PCR konvensional.
- Sejak awal, RT-PCR telah digunakan untuk mendiagnosis infeksi manusia oleh virus virus RNA.
- RT-PCR konvensional menunjukkan sensitivitas keseluruhan 73% hingga 100%, dan spesifisitas 99% hingga 100% untuk deteksi atau infeksi virus.
Keuntungan
- Sensitif, spesifik
- Potensi deteksi multipleks
Keterbatasan
- Menangani RNA mungkin terbukti sulit
- Potensi deteksi multipleks
- Ini memakan waktu dan rumit
- Relatif mahal
- Inhibitor tidak dianjurkan
- Beberapa virus RNA mungkin memiliki tingkat mutasi yang tinggi dan daerah mutan dalam PCR, yang dapat menyebabkan penurunan sensitivitas.
3. Real-Time PCR
- Sistem PCR waktu nyata memungkinkan amplifikasi dan deteksi asam nukleat virus secara simultan.
- Besarnya fluoresensi dari spesimen inilah yang akan menentukan adanya produk amplifikasi.
- Thermal cyclers monitor fluorescence emission khusus dari spesimen.
- SYBR green, TaqMan, dan bahan kimia suar molekuler dapat digunakan untuk mendeteksi dan mengukur produk amplifikasi.
- SYBR Green dye binds ke loop kecil double-stranded dsDNA (dsDNA), dan ketika dieksitasi oleh cahaya yang sesuai, ini menampilkan peningkatan fluoresensi. Hal ini berbanding lurus dengan jumlah dsDNA yang terakumulasi.
- Probe TaqMan adalah oligonukleotida DNA yang memiliki pewarna fluoresen yang disebut reporter di satu ujung dan quencher di ujung lainnya. Probe TaqMan dapat digunakan untuk hibridisasi dengan wilayah internal produk PCR.
Keuntungan
- Sangat sensitif dan tepat
- Operasi tabung tertutup mengurangi risiko kontaminasi silang.
- Cepat dan labor-intensive
- Deteksi Multipleks Genotipe
- Penentuan kuantitatif viral load
Keterbatasan
- Diperlukan peralatan laboratorium yang mahal dan probe fluoresen
- Desain probe TaqMan membutuhkan informasi lengkap tentang urutan asam nukleat target
- Metode SYBR green: Primer dimer artifact bisa menjadi masalah
- Inhibitor tidak dianjurkan
4. Metode Transcription-Based Amplification
- Metode amplifikasi berbasis transkripsi mencakup nucleic acid sequence-based amplification (NASBA) dan transcription-mediated amplification (TMA).
- TMA dan NASBA sangat mirip. Keduanya adalah teknik amplifikasi isotermal.
- Suhu di mana seluruh proses amplifikasi berlangsung adalah 41°C.
- Kedua kasus melibatkan konversi target RNA virus menjadi cDNA menggunakan RT, dan kemudian RNA Polimerase mensintesis banyak salinan.
- TMA dan NASBA memiliki dua enzim (RT) dan RNApolmerase (NASBA memiliki tiga enzim: Avian myeloblastosisvirus reverse transcriptase, RNase H dan T7 RNA Polymerase).
(i) proses NASBA
- Tiga enzim dan dua primer digunakan dalam proses NASBA untuk menggandakan RNA virus target.
- Primer 1 (P1) memiliki pada 5′ End T7 RNA Polymerase Promotor Region, dan pada 3' End P1 membawa urutan yang melengkapi urutan RNA virus target.
- Primer 2 (P2) berisi urutan yang melengkapi untai cDNA.
- Reaksi amplifikasi dimulai dengan produksi oleh RT salinan cDNA dari DNA virus menggunakan P1.
- RNase H bertanggung jawab untuk menghilangkan RNA virus dari molekul hibrid RNA DNA.
- Untai DNA yang dilepaskan kemudian digunakan untuk mensintesis molekul dsDNA oleh RT.
- T7 RNA Polymerase juga menggunakan molekul dsDNA untuk membuat template untuk menyalin banyak salinan RNA virus.
- Siklus ini dapat diulang berkali-kali dan menghasilkan akumulasi banyak salinan DNA virus dan molekul dsDNA.
- Anda dapat mendeteksi produk yang diperkuat baik dengan elektroforesis gel pada akhir pengujian, atau secara real-time menggunakan suar molekuler.
- Salah satu keuntungan amplifikasi berbasis transkripsi adalah tidak memerlukan siklus termal. Ini berarti bahwa negara berkembang dan laboratorium dengan anggaran terbatas dapat melakukan pengujian. Mereka juga memiliki kinetika yang cepat (membutuhkan lebih sedikit siklus) dan menghasilkan produk DNA untai tunggal yang cocok untuk dideteksi menggunakan berbagai teknik.
- Untuk mendiagnosis infeksi virus manusia yang disebabkan virus RNA, Metode Amplifikasi berbasis Transkripsi adalah tepat.
- Mereka dapat mengamplifikasi RNA pembawa pesan virus, RNA genomik virus, dan DNA ribosom.
Aplikasi
- Ayele dkk. Ayele dkk. Uji ini mampu mendeteksi subtipe C dan C dengan sensitivitas dan spesifisitas tinggi (sensitivitas 90,5%, spesifisitas 100% dan spesifisitas 95,2% masing-masing untuk suar C) dan pengurutan dianggap sebagai standar emas untuk genotipe.
- Moore dkk. NSABA juga digunakan untuk mendeteksi infeksi virus influenza A H5N1 pada spesimen klinis. Ini memiliki LoD pada 10 salinan RNA / ml, sensitivitas dan waktu penyelesaian yang sama dengan RTPCR.
- Tes NASBA digunakan untuk mendeteksi RNA virus dengue. Itu memiliki LoD 1 PFU/ml dan tidak ada reaksi silang dengan JEV. Waktu penyelesaian adalah 3 jam.
- Ender dkk. TMA digunakan untuk menyaring donor darah untuk HIV-1 dan HCVRNA. TMA memiliki LoDs 16,2 IU/ml HIV-1 dan 3,5IU/ml HCV.
- Multipleks NASBA digunakan untuk mendeteksi HIV-1 dan HCV secara bersamaan dari sampel plasma. LoD HIV-1 dan HCV adalah 1000 kopi/ml. Tidak ada reaksi silang.
- Swenson dan rekan kerjanya menggunakan TMA waktu nyata untuk mendeteksi HSV-1 dalam sampel usap lesi. Mereka memiliki sensitivitas keseluruhan pada 98,2%, 99,4%, dan spesifisitas pada 97,8%, masing-masing, dibandingkan dengan kultur.
(ii) uji berbasis TMA
- Tes berbasis TMA untuk deteksi HIV-1 dan HCV tersedia secara komersial. Mereka dikembangkan oleh Hologic (San Diego CA, USA).
- Uji kualitatif HCVRNA Aptima dapat digunakan untuk mendeteksi HCVRNA dalam serum atau plasma.
- TMA digunakan untuk memperkuat kawasan konservasi dalam genom 5′-UTR HCV.
- Uji ini memiliki LoD 7,5IU/ml dan spesifisitas 99,6%.
- BioMerieux Clinical Diagnostics juga menawarkan kit berbasis NASBA yang tersedia secara komersial untuk mendeteksi HIV-1, CMV, dan enterovirus.
- BioMerieux, Marcy l'Etoile di Prancis mengembangkan uji NucliSens Easy Q RSV B. Ini digunakan untuk mendeteksi RSV dalam berbagai jenis sampel pernapasan.
- Pengujian ini menggunakan NASBA waktu nyata dan menargetkan gen F RSV.
- Keuntungan dari TMA dan NASBA
- Sensitif, spesifik
- Ini sederhana dan cepat (lebih sedikit siklus yang dibutuhkan).
- Potensi untuk multiplexing
- Hitungan
- Genotipe
- Tidak memerlukan siklus termal, karena reaksi terjadi secara isotermal pada 41°C
- Keterbatasan TMA dan NASBA
- Menangani RNA mungkin terbukti sulit
- Tiga enzim diperlukan untuk NASBA
- Penggunaan enzim yang tidak termostabil
- Karena suhu di mana amplifikasi berlangsung lebih rendah (41degC), interaksi non-spesifik dapat meningkat.
5. Loop-Mediated Isothermal Amplification (LAMP)
- LAMP merupakan alternatif metode amplifikasi asam nukleat isotermal. Ini banyak digunakan untuk deteksi virus DNA dan RNA yang sensitif, spesifik dan cepat dalam spesimen manusia.
- Notomi dan rekan-rekan yang pertama mengembangkan metode ini. Ini dengan cepat mendapatkan popularitas dalam viralology diagnostik.
- Untuk mengamplifikasi DNA target, metode ini menggunakan empat hingga enam primer dan DNA polimerase yang berbeda dengan aktivitas pemindahan untai DNA.
- Uji LAMP dapat digunakan untuk mendeteksi dengan cepat berbagai virus DNA dalam sampel manusia. Ini termasuk HSV-1 dengan LoD 10 salinan HSV-1DNA/ml tanpa reaktivitas silang dan tanpa reaksi silang dengan virus pilihan lainnya. hAdV40/hAdV41 dengan LoD antara 50 dan 100 DNA/reaksi tanpa reaktivitas silang dan waktu penyelesaian 60 menit. EBV dengan sensitivitas dan spesifisitas 86,4% dan CMV dengan LoD 10 salinan/ml DNA tanpa reaktivitas silang dan 1 jam setelah ekstraksi RNA.
Keuntungan
- Sangat sensitif dan presisi.
- Hal ini mudah dilakukan.
- Itu tidak memerlukan pengendara sepeda termal yang mahal.
- Cepat (hasil dalam 1 jam).
- Kuantitatif.
- Genotip.
- Sistem deteksi sederhana (menggunakan mata telanjang).
- Sampel relatif tahan terhadap inhibitor apapun.
Keterbatasan
- Diperlukan enam primer
- Ada risiko tinggi kontaminasi silang
- Multiplexing
- Sifat subjektif dari deteksi visual dengan mata telanjang tergantung pada persepsi warna.
6. DNA Microarrays
- Teknologi microarray DNA memiliki kemampuan untuk mendeteksi virus medis.
- Untuk diagnosis microarray DNA, asam nukleat virus berlabel fluoresensi dalam spesimen uji digunakan untuk menyaring berbagai masalah oligonukleotida yang diimobilisasi pada permukaan padat (misalnya slide kaca).
- Probe oligonukleotida ini khusus untuk genom virus target.
- Deteksi berbasis fluoresensi memungkinkan kuantifikasi hasil hibridisasi antara probe yang diimobilisasi, urutan target dengan pewarna fluoresen, dan digunakan untuk mendeteksi dan mengukurnya.
- Microarray DNA digunakan untuk menemukan anggota virus corona baru selama wabah SARS 2002 di Cina.
- Teknologi microarray DNA memungkinkan deteksi multipleks virus potensial dalam spesimen klinis. Ini adalah alat yang sangat throughput.
Keterbatasan
- Diagnosis klinis rutin terlalu mahal.
- Ini labor-intensive dan
- Ini memakan waktu (proses hibridisasi bisa memakan waktu hingga beberapa hari).
- Hanya patogen virus dengan probe target yang terdeteksi oleh pengujian.
7. Next-Generation Sequencing (NGS)
- NGS adalah alat yang sangat berguna dalam mendiagnosis virologi karena dapat menganalisis fragmen asam nukleat virus yang diekstraksi dari spesimen klinis.
- NGS umumnya melibatkan persiapan sampel uji, urutan fragmen asam nukleat target menggunakan satu atau lebih platform NGS dan analisis data urutan menggunakan alat bioinformatika yang sesuai.
Keuntungan
- NGS tidak tergantung pada pengetahuan sebelumnya tentang urutan genom patogen virus, tidak seperti PCR dan microarray DNA.
- Anda tidak memerlukan primer PCR spesifik target atau probe oligonukleotida.
Keterbatasan
- Butuh waktu lama.
- Volume sampel yang tinggi per putaran
- Sequencer itu mahal.
- Keterampilan dalam bioinformatika diperlukan.













No comments