Kemoterapi antivirus
Kemoterapi Antivirus
Vaksin sejauh ini memegang posisi sentral dalam upaya
menghentikan virus. Mereka tidak mahal dan aman, dan perlindungannya bisa
bertahan lama. Tetapi beberapa virus karena beberapa alasan, tidak kompatibel
dengan metode ini seperti retrovirus, influenza, serta rhinovirus dan
arbovirus.
Beberapa kendala dalam penggunaan vaksin adalah (1)
keragaman serotipe mis. rhinoviruses togaviruses, rhinoviruses (2) perubahan
pada gen mis. retrovirus, influenza serta (3) Infeksi yang bersifat laten.
Sudah lama sejak hasil penting dalam skala besar dibuat dengan obat antivirus
seperti Acyclovir dan AZT ketika tidak ada vaksin.
Namun. Asiklovir dan AZT tidak seperti penisilin dalam
spektrum aktivitasnya, atau dalam tingkat penghambatannya. Mereka lebih seperti
beberapa obat antibakteri yang pertama kali keluar seperti salvarsan. Tak satu
pun dari senyawa antivirus yang diuji mampu menghentikan sepenuhnya replikasi
virus apa pun, dan virus tertentu tampaknya selalu mampu melewati blokade yang
disebabkan oleh obat-obatan.
Komposisi Senyawa Antivirus
Tidak banyak batasan pada jenis molekul yang menghalangi
replikasi virus, setidaknya di dalam lab. Mereka beragam dalam hal kuantitas
dan kompleksitas. Mereka termasuk produk alami yang ditemukan pada tumbuhan,
polisakarida oligonukleotida sintetis, senyawa anorganik dan organik dasar, dan
analog nukleosida. Beberapa contoh senyawa antivirus yang saat ini digunakan
antara lain:
Analog nukleosida: Ribuan analog nukleosida alami
sekarang sedang dibuat dan diuji di laboratorium pada awalnya sebagai agen
anti-herpesvirus dan sejumlah besar sedang diuji untuk obat anti-HIV. Di
samping amino nukleosida purin dan pirimidin, aranukleotida atau aza-nukleosida
sedang disintesis. Satu pergeseran atom dapat mengubah molekul aktif menjadi
molekul tidak aktif.
Analog pirofosfat: Forscarnet adalah contoh analog
dengan pirofosfat. Ini secara khusus memblokir polimerase DNA herpesvirus pada
situs pengikatan pirofosfat dan juga memiliki aktivitas anti-HIV.
Molekul Amantidine: Senyawa kimia amantidine
disetujui untuk menyembuhkan infeksi influenza A. Penambahan pengelompokan
metil (rimantidine) mengubah profil kimia obat dan menghalangi masuknya ke
dalam otak, yang dapat mengurangi efek samping yang dikenal sebagai
“kegelisahan”.
Resistensi virus terhadap inhibitor
Salah satu aspek yang mengecewakan dari terapi antivirus adalah ketidakmampuan hingga saat ini obat antivirus apa pun untuk menghentikan replikasi virus sepenuhnya. Aktivitas antivirus diketahui menyebabkan peningkatan 100-1000 persen penurunan titer virus yang, meskipun signifikan, memungkinkan beberapa partikel penyebab virus bertahan. Hal ini dapat memiliki implikasi serius bagi pasien dengan tubuh immunocompromised yang mungkin tidak dapat membasmi virus sisa. Tidak diketahui secara pasti apakah virion ini resistan terhadap obat atau jika mereka berbeda secara biologis atau genetik dari bagian utama populasi.
Cara Kerja Senyawa Antivirus
1. Cell-free virus
Beberapa obat antivirus menghambat atau memblokir virus
ekstraseluler dalam sel hidup. Satu pengecualian adalah garis senyawa WIN yang
mengikat protein eksternal picornavirus. Mereka mampu mengikat dan
mengintegrasikan ke dalam ngarai yang ada di bagian atas virus picornavirus,
akibatnya menstabilkan partikel dan mencegah lapisan terlepas.
2. Adsorpsi Virus
Ada sejumlah besar penelitian dalam pengembangan senyawa
yang dapat mencegah virus menempel pada sel yang rentan. Untuk HIV yang
berikatan dengan reseptor CD4, peptida yang pendek telah dibuat sesuai dengan
urutan situs pengikatan reseptor pada molekul CD4, serta protein pengikat
Gp120. Peptida ini akan menghambat interaksi antara daerah reseptor dengan
Gp120, tanpa mempengaruhi fungsi reseptor CD4 lainnya.
Maraviroc, obat anti-HIV, bertindak sebagai penghambat
masuk. Reseptor kemokin CCR5 adalah koreseptor penting dari sebagian besar
jenis HIV. Maraviroc adalah reseptor yang mengikat CCR5 yang menghalangi
protein HIV Gp120 HIV untuk bergabung dengan reseptor di sel seluler dan
membuatnya tidak efektif untuk diserap oleh makrofag manusia dan sel T. Karena
HIV juga dapat menggunakan koreseptor lain seperti CXCR4 dan CXCR4, uji
tropisme HIV seperti uji trofile harus dilakukan untuk menentukan apakah obat
tersebut efisien.
3. Masuk dan keluarnya virus
Virus influenza dan flavivirus tertentu diperkenalkan
melalui viropexis atau engulfment. Kemudian, segera setelah itu, dalam
endokista sitoplasma (vakuola) ia memulai fusi antara membran kaya lipid virus
dan membran intraseluler vakuola.
Prosesnya dikendalikan oleh asam amino, atau oleh salah satu
glikoprotein yang dihasilkan virus. Suatu zat yang mengganggu proses fusi dapat
menghentikan replikasi pada tahap awal ini. Jika influenza A, urutan fusi
molekul HA hanya mampu bertindak sebagai respons terhadap penataan ulang tiga
dimensi struktural molekul HA.
Perubahan besar, yang menyebabkan trimer HA mengembang
seolah-olah kelopak bunga kemungkinan hanya terjadi pada pH 5,5 yang lebih
rendah yang ditemukan di vakuola lisosom. Amantidine diyakini memblokir
replikasi influenza A dengan meningkatkan pH dalam sitoplasma vakuola, yang
mencegah fusi yang diinduksi virus, dan dengan demikian mencegah virus larut.
Virus berselubung lainnya, seperti paramyxovirus dan HIV
dapat memasuki sel melalui fusi yang diinduksi virus dengan membran plasma sel.
Ada kemungkinan bahwa "fusi dari luar" ini mungkin rentan terhadap
peptida dengan rantai pendek yang dapat bertindak pada urutan fusi dengan cara
ekstraseluler.
4. Transkripsi dan translasi asam nukleat virus dan
pelepasan virus
Mayoritas obat antivirus saat ini digunakan karena mereka memblokir transkripsi atau replikasi dalam asam nukleat virus.
Herpes DNA inhibitors Polymerase – sejauh ini, obat
yang paling cocok untuk terapi antivirus adalah DNA polimerase dari herpes
simpleks. Zat antivirus paling efisien yang telah dikembangkan adalah
asiklovir, yang menghalangi fungsi enzim ini. Obat antivirus yang paling efektif
harus (1) diserap hanya oleh sel yang terinfeksi virus (2) molekul penghambat
harus dibuat dalam sel yang dipengaruhi oleh aktivitas enzim (3) Inhibitor
harus mampu memberikan dampak spesifik pada enzim virus. Asiklovir menunjukkan
semua sifat di atas.
Inhibitor reverse transcriptase dalam DNA virus – AZT
dan banyak senyawa lain berfungsi sebagai terminator rantai. Trifosfat AZT
mampu mengikat dan memblokir RT virus lebih baik daripada polimerase DNA
standar di dalam sel dan spesifisitas antivirus dapat diperoleh. Namun, itu
tidak seefektif asiklovir dalam hal sifat antivirus. Hal ini dapat dilihat pada
efek toksik yang disebabkan oleh AZT dalam penggunaan klinis. Toksisitas yang
diperantarai sel dapat dijelaskan sebagian karena enzim sel normal memfosforilasi
AZT, dan oleh karena itu diaktifkan pada sel yang terinfeksi dan tidak
terinfeksi.
5. Translation
Ada kemungkinan untuk mengubah mRNA virus. Oligonukleotida
anti-indra kecil dibuat yang kompatibel dengan gen tertentu, misalnya gen rev.
Fomivirsen (Vitravene) adalah oligonukleotida anti-sense dengan 21 basa yang
kompatibel dengan wilayah awal dua mRNA CMV. Ini disetujui untuk pengobatan
regional CMV Retinitis untuk pasien AIDS.
6. Perakitan
Protease HIV sangat penting untuk pembelahan fusi protein
gag-pol. Penghambat enzim ini dapat menyebabkan penyumbatan perakitan HIV.
Contoh Agen Antivirus yang Biasa Digunakan
1. Asiklovir
Asiklovir adalah analog dari nukleosida guanin sintetis.
Fase pertama foshorilasi ACV monofosfat dijalankan oleh timidin Kinase spesifik
virus, bukan oleh Kinase seluler. Monofosfat tidak dapat melarikan diri dari
sel yang terinfeksi dan senyawa non-terfosforilasi mampu mengisi kembali
hilangnya konsentrasi intraseluler dan kemudian diubah menjadi monofosfat.
Dengan cara ini, obat menumpuk di sel yang terinfeksi herpes
daripada di rekan yang tidak terinfeksi. Monofosfat kemudian diubah menjadi
bentuk di – dan tri-fosfat melalui enzim sel. ACV triphosphate, versi paling
aktif secara farmakologis dari obat tersebut. Ini memblokir polimerase DNA
herpes tetapi memiliki sedikit dampak pada polimerase DNA sel inang.
Ia juga memiliki aktivitas pemutusan rantai, yang berarti
bahwa ia bertindak sebagai “suicide inhibitor” Strain HSV yang resisten
terhadap asiklovir mengandung varian gen timidin atau timidin kinase virus atau
DNA polimerase virus. Asiklovir juga merupakan sifat antivirus terhadap virus
herpes lainnya, seperti VZV CMV, VZV, dan EBV namun mekanismenya tidak dipahami
dengan baik dalam kasus ini. Forscarnet adalah obat pilihan untuk pengobatan
strain resisten asiklovir.
2. Valasiklovir
Valacylovir adalah ester dari asiklovir yang diserap dengan
baik. Bioavailabilitasnya 2-5* lebih banyak daripada asiklovir. Ini digunakan
untuk pengobatan dan pengendalian herpes genital.
3. Famsiklovir
Famiciclovir adalah prodrug untuk penciclovir, yang
merupakan versi aktif dan analog dengan guanosin. Ini memiliki bioavailabilitas
tinggi 77 persen. Ini diubah menjadi penciclovir dalam proses dua langkah.
Langkah pertama terjadi di usus, dan yang kedua terjadi di hati. Ini memiliki
waktu paruh yang panjang di dalam usus. Ia memiliki afinitas yang lebih besar
untuk HSV Timidin kinase atas asiklovir namun, ia memiliki afinitas yang lebih
rendah terhadap DNA polimerase HSV daripada Asiklovir.
Ini adalah penghambat enzim DNA polimerase virus dan juga
terminator rantai. Saat ini, famciclovir disetujui untuk pengobatan herpes
zoster. Dosisnya adalah 250mg TDS. Hal ini juga digunakan dalam pengobatan dan
pencegahan infeksi herpes genital.
4. Gansiklovir
Gansiklovir adalah nukleosida berbasis guanin yang secara
kimiawi terhubung dengan Asiklovir. Ini berfungsi sebagai terminator rantai dan
kemudian penghentian replikasi DNA virus. Versi aktifnya diyakini trifosfat.
CMV tidak menentukan TK karena proses fosforilasi pertama gansiklovir diyakini
dikendalikan oleh enzim lain di dalam sel.
Gansiklovir adalah tindakan in vitro yang sangat kuat
terhadap semua virus herpes, termasuk CMV. Ia juga aktif dalam virus DNA lain,
seperti adenovirus dan vaccinia. Gansiklovir lebih efektif melawan CMV daripada
Asiklovir. Gansiklovir telah terbukti bermanfaat untuk mengobati infeksi CMV
yang serius pada pasien dengan gangguan sistem kekebalan terutama bila dikombinasikan
dengan imunoglobulin yang hiperimun. Neutropenia reversibel adalah salah satu
reaksi merugikan yang paling sering dilaporkan.
Resistensi Gansiklovir didokumentasikan pada pasien dengan
kondisi immunocompromised yang menerima pengobatan untuk penyakit CMV. Hal ini
diduga disebabkan oleh kurangnya proses fosforilasi obat melalui sel yang
terkena CMV. Sebuah penelitian baru-baru ini yang dilakukan secara prospektif
menemukan bahwa 8 persen pasien yang menerima gansiklovir selama lebih dari
tiga bulan didiagnosis dengan CMV yang resistan.
5. Ribavirin
Ribavirin adalah nukleosida triazol buatan, dan bentuk
aktifnya disebut ribavirin trifosfat. Itu tidak dimasukkan ke dalam struktur
DNA atau RNA dasar selama proses seluler mensintesis asam nukleat. Dalam kasus
virus influenza, ia memblokir tutup 5′ yang ditemukan pada mRNA virus.
Ini juga telah terbukti memblokir RNA polimerase virus
influenza. Lebih lanjut diyakini bahwa ribavirin trifosfat mengganggu berbagai
langkah replikasi virus dan dapat menjadi alasan ketidakmampuan untuk
mengidentifikasi jenis virus yang tidak resisten terhadap ribavirin.
Ribavirin telah ditemukan efektif melawan virus DNA dan RNA
di dalam sel yang terinfeksi. Itu ditemukan untuk menjadi aktif terhadap
adenoviruses Herpesviruses, herpesviruses, CMV. vaksinia. influenza A dan B,
parainfluenza 1, 2, 3, campak, gondongan, RSV, rhinovirus. Ribavirin adalah
kontribusi yang signifikan untuk pengobatan anak-anak yang terinfeksi oleh RSV
yang diberikan sebagai aerosol selama rawat inap.
Ini juga telah terbukti efektif terhadap kedua influenza B.
Juga dilaporkan berguna untuk mengobati penyakit Hantavirus demam Lassa,
hepatitis C.
6. Zidovudin (AZT)
AZT adalah analog sintetik dari bahan kimia timidin. Ini
membutuhkan konversi menjadi bentuk trifosfat melalui enzim sel. Ini memblokir
transkriptase balik virus melalui bertindak sebagai agen pemutusan rantai.
Transkriptase balik yang berasal dari virus dapat 100 kali lipat lebih rentan
untuk dihambat melalui zidovudin trifosfat dibandingkan dengan polimerase DNA
sel inang.
Ketika virus dimasukkan ke dalam rantai DNA-nya, sintesis
DNA virus berhenti karena tidak ada lagi ikatan fosfodiester yang terbentuk.
AZT efektif secara in vitro terhadap berbagai retrovirus dalam tubuh manusia,
termasuk HTLV-I serta HIV. Indikasi AZT saat ini adalah pengobatan pasien
dengan infeksi HIV yang kekebalannya berkurang. (Jumlah sel T4 adalah 400-500
atau kurang) Telah terbukti memperpanjang umur pasien yang menderita HIV. Ini
juga telah terbukti bermanfaat bagi pasien yang tidak menderita gejala, namun
ini bukan konsensus.
7. Lamivudin
Lamivudine adalah inhibitor kuat dari reverse transcriptase.
Biasanya ditoleransi dengan baik oleh pasien. Sekarang sering menjadi bagian
integral dari kombinasi terapi pasien HIV. Baru-baru ini, telah disetujui untuk
mengobati Hepatitis B kronis.
8. Forscarnet
Forscarnet adalah analog berbasis pirofosfat dan, tidak
seperti analog nukleosida, forscarnet tidak perlu mengaktifkan Kinase sel atau
virus. Forscarnet mengikat langsung pada situs pengikatan pyrophoshate DNA
polimerase dan RNA.
Forscarnet sulit diberikan karena perlu diberikan terus
menerus melalui infus menggunakan pompa infus. Ini digunakan untuk mengobati
retinitis CMV di antara pasien AIDS yang menerima terapi AZT, karena tidak
memiliki efek samping yang tumpang tindih dengan AZT. Ini juga digunakan untuk
mengobati infeksi HSV resistif AZT. Efek samping yang paling signifikan adalah
pada fungsi ginjal.
9. Amantidin
Senyawa tersebut menghambat pertumbuhan virus influenza pada
kultur sel serta dalam percobaan dengan hewan. Amantidine hanya efektif melawan
influenza A dan beberapa bentuk influenza A yang diproduksi secara alami tidak
terpengaruh olehnya. Mekanisme kerja amantidine amantadine tidak dipahami. Hal
ini diyakini bekerja dalam bentuk virus uncoating.
Obat ini telah terbukti memiliki efek menguntungkan dan
terapeutik. Amantidine secara signifikan menurunkan waktu demam (51 jam,
dibandingkan durasi 74 jam) dan juga penyakit. Obat itu juga memberikan
perlindungan 70 persen terhadap influenza A ketika diberikan sebagai
profilaksis.
Amantidine dapat memicu gejala neurologis ringan, seperti
kecemasan, insomnia, dan kebingungan mental. Tapi, gejala ini berkembang pesat
pada mereka yang rentan dan menghilang saat pengobatan dihentikan. Tindakan
terapeutik dan profilaksis amantidine saat ini diakui secara luas dan berbagai
analog senyawa telah dibuat.
Rimantadine tidak seefisien amantadine, tetapi kurang
berbahaya. Salah satu alasan yang menghambat keefektifan amantidine dan
rimantidine adalah perkembangan resistensi yang cepat terhadap molekulnya, yang
terlihat pada sekitar 30 persen pasien. Mutan yang resisten ini diyakini sama
rentannya untuk menginfeksi orang lain dan menyebabkan penyakit seperti virus
liar.
10. Zanamivir
Pendekatan empiris untuk pengembangan obat dapat mengarah
pada pengembangan beberapa inhibitor kuat untuk neuraminidase influenza. Dari
jumlah tersebut, dua adalah oseltamivir dan zanamivir. Mereka disetujui untuk
pengobatan influenza A dan B.
Uji klinis telah menunjukkan bahwa kedua obat telah
menunjukkan kemanjuran, tanpa konsekuensi yang merugikan. Karena
bioavailabilitasnya yang tidak mencukupi, Zanamivir harus diberikan melalui
inhalasi, sedangkan oseltamivir dapat diberikan secara oral. Karena
perkembangan mutan yang resistan terhadap obat yang ditandai dengan perubahan
pada NA merupakan proses yang membutuhkan waktu lama dalam kultur jaringan,
perkembangan virus yang resistan terhadap zanamivir tidak mungkin terjadi
secara umum pada pasien.
Informasi yang tersedia menunjukkan bahwa mutan bisa menjadi
kurang stabil secara in vivo. Dampak dari perubahan ini pada reseptor
hemagglutinin masih harus dinilai. Secara keseluruhan , obat anti-influenza
kelas NA telah menunjukkan harapan besar. varian resisten tidak sering
ditemukan dan dapat mengakibatkan melumpuhkan secara biologis.
11. Imunoglobulin
Imunoglobulin ditawarkan dalam tiga bentuk: intramuskular,
IVIG dan hyperimmuneglobulin untuk melawan virus tertentu. Imunoglobulin
memiliki lebih banyak kemanjuran ketika digunakan untuk pencegahan daripada
terapi.
Saat ini, HNIG digunakan terutama untuk mencegah hepatitis
A. HNIG juga dapat diberikan kepada kontak yang tidak terinfeksi campak.
Globulin hiperimun dapat digunakan dalam pencegahan pasca pajanan hepatitis B
serta cacar air dan rabies. Mereka juga telah digunakan dalam pengobatan
infeksi Arenavirus, Demam berdarah Krimea-Kongo bersama dengan demam lembah
Rift. CMV Ig diresepkan sebagai pengobatan pencegahan untuk penerima ginjal
yang seronegatif dari donor dengan status seropositif.
Aplikasi untuk profilaksis CMV Ig pada pasien BMT bukanlah
konsensus. CMV IVIG digunakan bersama dengan gansiklovir dalam terapi
pneumonitis yang disebabkan oleh CMV. IVIG juga digunakan untuk pengobatan
meningoensefalitis enteroviral kronis di antara anak-anak yang menderita agammablobinaemia.
Terapi Anti-HIV
Sejumlah besar uang yang dicurahkan untuk penelitian HIV
mengarah pada pengembangan sejumlah besar obat anti-HIV. Laju pesat kemajuan di
bidang ini tak tertandingi dalam waktu kedokteran dan merupakan salah satu
pencapaian yang paling signifikan. Sampai hari ini, dengan pengobatan yang
tepat, sama sekali tidak ada alasan untuk percaya bahwa orang yang terinfeksi
HIV tidak dapat menikmati harapan hidup yang sama dengan orang yang sehat.
Pengobatan untuk HIV rumit karena fakta bahwa genom HIV terintegrasi ke dalam genom sel inang dan mampu tetap dalam kondisi tidak aktif untuk jangka waktu yang lama sebelum diaktifkan. Meskipun mungkin tidak mungkin untuk menghilangkan virus sepenuhnya, ada kemungkinan bahwa penyakit ini dapat dikendalikan tanpa batas waktu untuk memastikan bahwa orang yang menderita HIV kemungkinan besar meninggal karena penyakit HIV, bukan karena penyakit tersebut.
Zidovudine (AZT) adalah obat antivirus pertama yang
digunakan untuk mengobati HIV dan disetujui pada tahun 1987. Namun, terbukti
dalam penelitian Concorde pada tahun 1994, bahwa monoterapi menggunakan AZT
tidak memberikan kemanjuran yang bertahan lama dan hampir tidak membuat
perbedaan dalam tingkat kematian. Pada tahun 1995, temuan dari studi seperti
studi DELTA Eropa dan studi ACTG 175 Amerika menjadi tersedia dan menunjukkan
bahwa terapi kombinasi dari dua analog nukleosida lebih efektif daripada
monoterapi yang menggunakan satu.
Terobosan lain adalah pengembangan protease inhibitor HIV
yang dirancang khusus untuk memerangi protease HIV. Mereka telah terbukti
memiliki efek terkait HIV paling efektif yang tersedia saat ini. Sebuah studi
klinis awal mengungkapkan bahwa penggunaan ritonavir oral mengurangi kematian
akibat HIV dari 38 persen menjadi 22 persen. Terapi kombinasi, juga dikenal
dengan nama ART (pengobatan antiretroviral yang sangat aktif) dengan tiga atau
lebih agen diperkenalkan.
Alasan untuk strategi ini dapat diturunkan dari gagasan
bahwa dengan menggunakan obat-obatan yang sinergis, resisten silang dan tanpa
toksisitas yang tumpang tindih, adalah mungkin untuk menurunkan toksisitas,
meningkatkan efektivitas, dan menghentikan berkembangnya resistensi. Terobosan
pamungkas datang pada tahun 1996 ketika David HO (Majalah Time Man of the Year
1996) akhirnya mengidentifikasi penyebab penyakit HIV.
Dia membuktikan bahwa, alih-alih terpendam dalam “fase
laten” seperti yang diyakini sebelumnya, ada replikasi besar-besaran saat ini.
David Ho telah menciptakan ungkapan "pukul keras dan awal". Hasil
dari metode baru ini terbukti dengan cepat. dalam waktu empat tahun, dari tahun
1994 hingga 1998 tingkat AIDS di Eropa turun menjadi 30,7 dari 30,7 menjadi
2,5/100 tahun yaitu menjadi kurang dari 10 persen.
Kurangnya harapan adalah kesempatan untuk menghilangkan HIV
dari tubuh manusia yaitu penyembuhan total. Pada awalnya diyakini bahwa
pengobatan terus menerus selama tiga tahun sudah cukup untuk menghilangkan
semua sel kanker yang tersisa yang belum terinfeksi. Namun, durasi pengobatan perlu
terus disesuaikan seiring dengan semakin banyaknya penelitian yang dilakukan.
Perkiraan terbaru eliminasi semua sel yang terinfeksi secara laten adalah 73,3
tahun.
Oleh karena itu jelas bahwa tidak mungkin untuk mencapai
kesembuhan total dalam waktu dekat. Penting untuk dapat mematuhi kapan
pengobatan akan berlangsung seumur hidup. Ada kebutuhan yang jelas untuk
mengembangkan formulasi di mana jumlah tablet yang harus dikonsumsi setiap hari
dikurangi menjadi jumlah minimal yang mutlak. Perkembangan efek samping dengan
penggunaan obat jangka panjang adalah masalah lain.
Ketika komunitas ilmiah memperoleh pengetahuan tentang
bahaya dan efektivitas berbagai rejimen dan obat-obatan, rekomendasi untuk HIV
terus diperbarui. Oleh karena itu, alih-alih "memukul dengan keras dan
lebih awal" sekarang beralih ke "memukul dengan keras, tetapi hanya
jika diperlukan". Ada banyak perdebatan tentang waktu terbaik untuk
memulai terapi.
Dua kriteria digunakan untuk menentukan apakah sudah
waktunya untuk memulai pengobatan HIV: jumlah CD4 dan viral load. Ada
kesepakatan umum bahwa terapi HIV harus dimulai setiap kali jumlah CD4 Anda
lebih rendah dari 200. Para ahli tertentu menyarankan pengobatan untuk siapa
saja yang jumlah CD4-nya lebih rendah dari 350. Tidak begitu jelas untuk pasien
yang memiliki jumlah CD4 300-500 , dan viral load sedang. Keputusan untuk
memulai pengobatan harus dibuat secara pribadi dengan pasien setelah diskusi
dan konseling yang panjang.
Agen Anti-Retroviral
A. Inhibitor Transkriptase Terbalik Nukleosida
- Zidovudin (Retrovir, AZT)
- Didanosin (Videx, Videx EC, ddI)
- Stavudin (Zerit, d4T)
- Lamivudin (Epivir, 3TC)
- Abacavir (Ziagen, ABC)
- Tenofovir, analog nukleotida (Viread, TDF)
- Combivir (kombinasi zidovudine dan lamivudine)
- Trizivir (kombinasi zidovudine, lamivudine dan abacavir)
- Emtricitabine (Emtriva, FTC)
- Truvada (kombinasi emtricitabine dan tenofovir)
- Epzicom (kombinasi abacavir dan lamivudine)
B. Inhibitor Transkriptase Terbalik Non-Nukleosida
- Nevirapine (Viramune, NVP)
- Delavirdine (Reseptor, DLV)
- Efavirenz (Sustiva atau Stocrin, EFV, juga bagian dari Atripla)
- Etravirine (Intelence, ETR)
- Rilpivirine (Edurant, RPV, juga bagian dari Complera atau Epivlera).
C. Inhibitor Protease HIV
- Saquinavir (Invirase, SQV)
- Indinavir (Crixivan, IDV)
- Ritonavir (Norvir, RTV)
- Nelfinavir (Viracept, NFV)
- Amprenavir (Agenerase, APV)
- Lopinavir/ritonavir (Kaletra atau Aluvia, LPV/RTV)
- Atazanavir (Reyataz, ATZ)
- Fosamprenavir (Lexiva, Telzir, FPV)
- Tipranavir (Aptivus, TPV)
- Darunavir (Prezista, DRV)
- D. Inhibitor Masuk HIV
- Enfuvirtide (Fuzeon, ENF, T-20)
- Maraviroc (Selzentry atau Celsentri, MVC)
E. Penghambat integrase HIV
- Raltegravir (Isentress, RAL)
- Elvitegravir (EVG, bagian dari kombinasi Stribild)
- Dolutegravir (Tivicay, DTG)
- Ada sejumlah persiapan kombinasi di pasar mis. CBV (AZT+3TC), TZV (AZT+3TC+ABC), TVD (FTC+TDF), Kaletra (Lopinavir/ritonavir). Penggunaan sediaan kombinasi akan mengurangi mati rasa tablet yang perlu diminum setiap kali.
Memantau terapi anti-HIV
a. Viral Load
Inisiasi: Inisiasi viral load adalah metode yang paling umum
digunakan untuk memantau pengobatan. Harus ada lebih dari satu log penurunan
beban virus setidaknya 10.000 kopi per mililiter HIV-RNA dalam 2 sampai 4
minggu pertama setelah dimulainya pengobatan. Jika ada pengurangan <0,5
persen viral load, atau HIV-RNA, tetap di atas 100.000, rencana pengobatan
harus disesuaikan baik menambah atau mengganti obat.
Pemantauan: pengukuran viral load dianjurkan setiap 4-6
bulan, jika kondisi pasien stabil. Jika tingkat viral load meningkat menjadi
0,3-0,5 log dari tingkat sebelum pengobatan dan pengobatan tidak bekerja lagi
dan pengobatan harus diubah.
b. jumlah CD4
Inisialisasi: dalam 2-4 minggu setelah memulai pengobatan,
jumlah CD4 harus naik minimal 30 sel/mm3. Jika ini bukan masalahnya, Perawatan
harus diubah.
Pemantauan: Pemantauan jumlah CD4 harus diperiksa setiap 3
sampai 6 bulan selama periode stabilitas dalam kondisi klinis dan lebih sering
jika gejala penyakit berkembang. Jika jumlah CD4 turun di bawah tingkat dasar
(atau pertumbuhan kurang dari 50% dari sebelum pengobatan) dan pengobatan harus
diubah.
c. Tes Resistensi Obat Anti-HIV
Pengujian resistensi terhadap obat antiretroviral sekarang
menjadi bagian dari penanganan pasien di seluruh Amerika Utara dan Eropa Barat.
Banyak penelitian pada pasien yang berpengalaman dengan pengobatan telah
menunjukkan korelasi yang kuat dengan adanya resistensi obat dan ketidakmampuan
rejimen pengobatan untuk antiretroviral untuk mengurangi replikasi HIV.
Tes Genotipe: Tes genotipe menemukan mutasi pada gen
resistensi obat yang ditemukan pada gen virus yang bersangkutan (yaitu gen
protease dan RT). Tes genotipe tertentu memerlukan analisis RT lengkap dan gen
protease, metode lain menggunakan probe oligonukleotida untuk menemukan mutasi
spesifik yang diketahui memberikan resistensi terhadap obat. Tes genotipe dapat
dilakukan dengan cukup cepat, sehingga hasilnya tersedia dalam beberapa minggu
setelah pengambilan sampel. Interpretasi hasil dari tes tergantung pada pemahaman
variasi mutasi yang disaring oleh obat antiretroviral yang berbeda serta
kemungkinan resistensi silang terhadap obat lain yang dihasilkan dari mutasi.
Tes Fenotipik: tes fenotipik menguji kapasitas virus
untuk berkembang dalam dosis obat antiretroviral yang berbeda. Tes fenotipe
rekombinan otomatis sekarang tersedia secara komersial dengan waktu
penyelesaian 2-4 minggu, namun tes fenotipe biasanya lebih mahal untuk
dilakukan dibandingkan dengan tes genotipe. Tes fenotip rekombinan melibatkan
pengenalan RT atau gen protease yang berasal dari plasma pasien HIV RNA ke
dalam replika laboratorium HIV. Replikasi virus rekombinan pada konsentrasi
obat yang berbeda dipantau melalui ekspresi oleh gen yang disebut reporter.
Hasilnya dibandingkan dengan replikasi versi HIV yang tidak terkait. Tingkat
obat yang memblokir 50 persen dan 90% dalam replikasi virus (yaitu yang
memiliki IC50 atau IC90) dihitung. Persentase IC50 dari kedua tes dan virus
referensi diidentifikasi sebagai persentase peningkatan IC50 atau resistensi
lipat. Interpretasi hasil fenotip dapat menjadi rumit karena kurangnya
informasi tentang tingkat resistensi yang tepat (peningkatan lipat IC50) yang
dikaitkan dengan kegagalan berbagai obat.
Dalam pengaturan klinis, tes resistensi dapat bermanfaat jika
terjadi kegagalan virologi dalam terapi antiretroviral. Bukti berbasis
penelitian terbaru yang mendukung penerapan tes resistensi dalam praktik klinis
berasal dari penelitian di mana kemanjuran tes resistensi dievaluasi dalam
kasus kegagalan virologi. Dalam penelitian VIRADAPT DAN GART meneliti tanggapan
virologis terhadap rejimen pengobatan yang mencakup terapi antiretroviral dalam
hal tes genotipe yang digunakan untuk memandu pengobatan dan yang diamati
ketika perubahan pengobatan hanya didasarkan pada penilaian klinis. Temuan dari
kedua penelitian menunjukkan bahwa tanggapan virologi terhadap pengobatan
secara signifikan lebih besar ketika hasil tes resistansi tersedia. Selain itu,
penelitian multisenter, prospektif, dan acak baru-baru ini telah menunjukkan
bahwa pengobatan yang dipilih berdasarkan uji fenotipik untuk resistansi secara
signifikan meningkatkan pengobatan tanggapan virologi antiretroviral, bila
dibandingkan dengan terapi yang tidak didasarkan pada tes untuk fenotipe. Oleh
karena itu, tes resistansi diyakini menjadi alat yang efektif untuk menentukan
obat aktif ketika mengganti rejimen antiretroviral sebagai akibat dari masalah
virologi yang mendasarinya.
Kecepatan perkembangan dalam terapi anti-HIV berarti hampir
tidak mungkin bagi situs web ini untuk tetap up to date. Untuk informasi
terkini tentang HIV dan pengobatan anti-retroviral, saya akan merekomendasikan
halaman HIV di Medscape.com
Interferon
- Ada tiga jenis interferon: alfa beta, gamma, dan alfa.
- Interferon-a hadir dalam setidaknya 15 subtipe, dan gen yang terkait dengannya menunjukkan homologi 85 persen. IFN b1 menunjukkan 30% homologi dengan IFNa.
- IFNb2 sekarang disebut sebagai IFN-6. Ia tidak memiliki homologi dengan tipe alfa atau B1.
- IFN Gamma adalah limfokin inflamasi, dan tidak memiliki kesamaan dengan jenis lainnya.
- IFN bertanggung jawab atas tindakan mereka dengan mengaktifkan reseptor spesifik yang diaktifkan pada tingkat seperti hormon. Elemen respons yang dapat diinduksi interferon dalam genom sel diaktifkan.
- Ada dua jenis utama reseptor IFN. Satu untuk beta1 dan alfa, dan satu lagi untuk gamma.
- IFNs dilepaskan dari tipe sel yang berbeda sebagai respons terhadap infeksi virus Endotoksin, dsRNA, rangsangan yang bersifat mitogenik atau antigenik.
- DsRNA diyakini sebagai penginduksi yang sangat signifikan. Paling sering, penginduksi IFN terbaik adalah yang lambat berkembang biak dan tidak menghambat produksi protein inang dengan cepat atau menyebabkan kerusakan signifikan pada sel.
- IFN biasanya diukur dengan menganalisis dampaknya terhadap multiplisitas virus uji biasanya virus stomatitis vesikular salah satu rhabdovirus.
- Strain virus yang dapat menghasilkan produksi IFN tinggi menyebabkan gangguan otomatis selama pengujian titik akhir. Secara umum IFN Gamma berbeda dari yang lain karena dilepaskan dalam bentuk limfokin di sel T yang diaktifkan, dan terkadang dari makrofag.
Mekanisme Kerja Interferon
Manfaat antivirus IFN dicapai melalui berbagai saluran;
- Peningkatan produksi glikoprotein MHC Kelas I dan Kelas II, sehingga memfasilitasi pengenalan antigen virus oleh sistem kekebalan tubuh.
- Efek imunoregulasi – aktivasi sel yang dapat membunuh sel yang terinfeksi virus; ini termasuk makrofag NK dan NK. IFN mungkin bertanggung jawab atas evolusi dari sistem imun humoral ke seluler.
- Penekanan langsung replikasi virus berbagai mekanisme terlibat dalam jalur ketiga.
Produksi protein penghambatan spesifik seperti. protein Mx,
yang dikenal dengan efek anti-influenzanya. Ada kemungkinan bahwa protein
penghambat khusus tambahan mungkin ditemukan. Penghambatan proses virus,
seperti tunas, penetrasi, uncoating dan bahkan tunas dari sel yang terinfeksi
telah diamati.Tes in vitro menggunakan ekstrak dari sel yang diobati dengan IFN
menunjukkan bahwa tujuan utama dari tindakan IFN adalah translasi yang diblokir
oleh dua mekanisme, yang keduanya memerlukan kehadiran sejumlah kecil dsRNA. Proses
aktivasi Kinase dependen dsRNA. Ini memfosforilasi dan menonaktifkan faktor
inisiasi transkripsi eIF-2. Fosforilasi membekukan kompleks awal yang dibentuk
oleh eIF-2, GTP, met-tRNAf dan komponen ribosom kecil ribosom dan mRNA. Karena
eIF-2 tidak dapat didaur ulang, proses sintesis protein diperlambat atau
dihentikan. Proses aktivasi dari 2-5 oligo A synthetases (r) mensintesis 2-5A
(r) mengaktifkan endonuclease (sendiri diaktifkan melalui IFN) (r) penghancuran
mRNA (r) menghambat sintesis protein. Kombinasi pengurangan pertumbuhan sel dan
peningkatan CMI adalah alasan sifat antitumor IFN.
Peran protektif dalam infeksi virus
Fungsi protektif yang merupakan fungsi protektif IFN pada
hewan telah dikemukakan melalui berbagai penelitian;
- Pada tikus yang pulih dari infeksi virus influenza, tingkat IFN tertinggi pada saat virus mulai berkurang dan sebelum peningkatan Abs terdeteksi. Pada fase ini, level IFN cukup tinggi untuk memastikan jumlah IFN tikus cukup untuk melindungi mereka dari efek mematikan togavirus.
- Antiserum yang kuat untuk IFN secara signifikan meningkatkan keparahan infeksi virus hepatitis tikus.
- Tikus menyusui yang rentan terhadap virus coxsackie menghasilkan sejumlah kecil IFN sebagai respons terhadap virus ini, tetapi tikus dewasa yang kebal terhadap virus ini menghasilkan jumlah yang sangat besar.
Studi-studi ini menunjukkan bahwa IFN adalah fungsi
perlindungan utama setidaknya pada infeksi virus tertentu. Dinamika penyakit.
Kemungkinan penggunaan terapi Interferon
Secara klinis, antiinfeksi yang sangat efektif telah
terbukti melawan infeksi rhinovirus pada sukarelawan manusia, yang
mengakibatkan penurunan insiden infeksi serta penurunan gejala. Kontak dengan
pasien yang terinfeksi dilindungi dengan semprotan intranasal dengan IFN dalam
jumlah besar. Selain itu, ini mengurangi aktivasi CMV pada pasien dengan status
seropositif yang menerima transplantasi ginjal.
IFN secara teoritis dapat menjadi agen antivirus yang sangat
baik karena dapat efektif melawan berbagai macam virus dan menunjukkan
aktivitas yang tinggi. Namun, efektivitasnya dibatasi oleh beberapa alasan: IFN
bekerja hanya untuk waktu yang singkat dan tidak mempengaruhi proses sintesis
virus yang telah dimulai di dalam sel. Selanjutnya, dalam dosis tinggi mereka
dapat menyebabkan dampak buruk yang serius pada inang.
IFN eksogen untuk mengobati penyakit virus pada manusia
belum banyak berhasil. IFN-a memiliki efek profilaksis terhadap influenza
selama epidemi. Administrasi lokal mengurangi rasa sakit dan keparahan penyakit
pernapasan, IFN juga dilaporkan efektif dalam mengobati kutil kelamin, serta
papillomatosis laring remaja. Baru-baru ini, interferon alfa sintetis telah
disetujui untuk mengobati pembawa hepatitis B. Ini juga digunakan dalam
pengobatan pembawa hepatitis C yang menderita Hepatitis aktif kronis.
Terapi Interferon untuk Pembawa HBV Kronis
Dalam uji klinis awal terapi interferon telah dikaitkan
dengan hilangnya HBeAg di antara 30 dan 40 persen pasien. pada sekitar 10%, pasien
telah kehilangan HbsAg secara total. Jika pasien mengalami HBeAg selama
pengobatan, hilangnya HBsAg adalah hasil dari terapi pada sekitar 80 persen
pasien yang diikuti selama lebih dari satu dekade. Selain itu, peningkatan
kelangsungan hidup, kelangsungan hidup tanpa komplikasi serta penurunan
prevalensi karsinoma hepatoseluler telah diamati pada pasien yang telah
menanggapi interferon.
Pengobatan interferon paling efisien pada pasien yang
memiliki kadar DNA HBV rendah dengan 100.000 hingga 40 juta kopi per mililiter
dan ALT yang meningkat (terutama bila lebih besar dari 200 IU/mL) serta pasien
dengan gangguan sistem imun dan fungsi hati yang sehat (albumin, bilirubin, dan
koagulasi) serta perolehan infeksi di kemudian hari. Studi pertama menunjukkan
bahwa efektivitas interferon tidak setinggi pasien yang menderita penyakit HBV
pra-inti-mutan (strain HBeAg positif) namun, temuan terbaru telah mendorong
minat baru dalam terapi interferon karena alasan ini. Penelitian terbaru
mengenai interferon PEG mungkin mengarah pada penggunaan lini pertama produk
PEG sebagai obat yang berdiri sendiri atau dalam hubungannya dengan obat oral.
Interferon, bagaimanapun, membutuhkan terapi injeksi yang
tidak nyaman, datang dengan banyak efek negatif yang merugikan, dan tidak lebih
efektif daripada lamivudine dalam hal serokonversi eAg. Ini juga hanya bernilai
kecil untuk subkelompok tertentu, tetapi ini adalah satu-satunya pengobatan
yang menawarkan kemungkinan penyembuhan menyeluruh.
- Interferon Alpha (Intron A) diberikan melalui suntikan beberapa kali per minggu selama 6 bulan sampai 1 tahun atau lebih sering. Obat ini dapat menyebabkan efek samping seperti depresi, gejala seperti flu dan sakit kepala. Itu disetujui pada tahun 1991 dan itu tersedia untuk anak-anak maupun orang dewasa.
- Interferon Pegilasi (Pegasys) Peginterferon suatu bentuk interferon yang diubah yang telah diterima untuk pengobatan HBV serta HCV. Ini memiliki struktur kimia yang sebanding tetapi lebih kompleks dengan interferon-alfa. Ini meningkatkan kemanjuran obat ke titik itu hanya dapat diberikan setiap minggu dan biasanya berlangsung selama enam bulan atau satu tahun. Obat tersebut dapat menyebabkan reaksi samping seperti gejala seperti flu, depresi, dan masalah kesehatan mental lainnya. Itu disetujui untuk penggunaan orang dewasa pada Mei 2005.
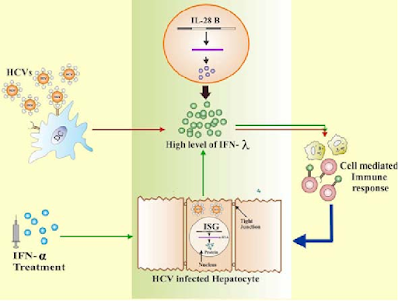
Terapi interferon Pembawa Hepatitis C
Saran saat ini adalah bahwa pengobatan interferon dapat
dipertimbangkan untuk pasien yang menderita penyakit hati aktif kronis yang
rentan untuk berkembang menjadi sirosis atau HCC. Dosis yang dianjurkan adalah
3 MU tds in sc atau im selama enam bulan. Tingkat responsnya sekitar 50 persen.
Namun, sekitar 50% dari mereka yang merespons kambuh setelah menghentikan
pengobatan.
Saat ini, tidak diketahui faktor apa yang mempengaruhi efektivitas
terapi interferon. Ada beberapa bukti yang menunjukkan bahwa pasien yang lebih
tua dan mereka yang memiliki sirosis yang sudah mapan bereaksi kurang efektif.
Ada semakin banyak bukti bahwa genotipe HCV yang menginfeksi mempengaruhi
respons terhadap IFN. Banyak pasien yang merespon akan melihat penurunan
dramatis tingkat SGPT dalam dua bulan pertama pengobatan dengan interferon.
Anda dapat mempertimbangkan dosis yang lebih tinggi seperti
lima atau 10 miligram untuk non-penanggap, tetapi tidak pasti apakah dosis yang
lebih tinggi efektif. Saat ini, tidak diketahui faktor apa yang paling mungkin
menyebabkan kemungkinan kambuh setelah perawatan. Jika seseorang kambuh setelah
pengobatan, mereka dapat menerima kursus kedua diikuti dengan perawatan pemeliharaan
selama enam sampai dua belas bulan.
Ada bukti bahwa kombinasi interferon dan ribavirin bisa
lebih unggul daripada interferon sendiri. Sebenarnya, persiapan obat yang
menggabungkan kedua agen ini tersedia untuk membantu dalam hal ini. Sekarang
pemeriksaan genotipe HCV menjadi rutin sebelum dimulainya pengobatan
Interferon/Ribavirin. Tipe 1 dan 4 memiliki prognosis yang kurang baik serta
respon pengobatan yang lebih rendah. Biasanya, pasien ini menerima pengobatan
selama 48 minggu daripada 24 minggu untuk genotipe lainnya.











No comments